Définition et principe
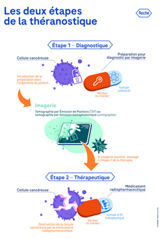
Le terme théranostique vient de la contraction des mots thérapeutique et diagnostic. Il décrit le fait d’utiliser un vecteur associé à un isotope radioactif dans le but de poser, dans un premier temps, un diagnostic par le biais d’une imagerie, puis dans un second temps, d’utiliser ce même traceur, couplé cette fois-ci à un isotope différent à des fins thérapeutiques (médicament radiopharmaceutique, MRP). Cette pratique permet d’identifier, suivre et traiter certains cancers.
Une même molécule permet ainsi, lors de l’étape de diagnostic, de détecter les cellules cancéreuses, mais aussi d’identifier les patients qui pourront bénéficier du traitement. Si l'imagerie est positive, cela signifie que le patient exprime les récepteurs-cibles des traitements et qu'il est donc éligible à l'étape thérapeutique. Lors de cette dernière, la même molécule marquée avec un isotope thérapeutique (émetteur ß- ou α par exemple) permet d’irradier les cellules cancéreuses en épargnant les tissus sains.
Les applications
Le volet « diagnostic » de la théranostique s’opère par le biais d’une imagerie de type tomographie par émission de positons (TEP) ou tomographie par émission monophotonique (scintigraphie).
Du côté thérapeutique, les modalités de prise en charge sont les mêmes que celles observées dans le cancer de la thyroïde avec le traitement par l'iode 131 pour détruire les cellules cancéreuses (dans ce cas, l’isotope radioactif est lui-même le traceur). Le corps médical parle de radiothérapie interne vectorisée (RIV).
Aujourd’hui, la théranostique trouve son avènement dans la prise en charge des cancers de la prostate et celui des tumeurs neuro-endocrines.
Pour pouvoir la mettre en place, il faut disposer de marqueurs spécifiques de la maladie :
Dans le cas du cancer de la prostate, les médecins nucléaires utilisent une cible de l’antigène membranaire spécifique de la prostate (PSMA), présent à des niveaux élevés à la surface des cellules cancéreuses, à la fois dans le tissu prostatique et les métastases. Ainsi, dans un premier temps, ce PSMA est couplé au Gallium 68 (68 Ga) pour identifier par le biais d’une imagerie TEP la présence de récepteur PSMA dans la tumeur et d’éventuelles métastases. Si l’imagerie est positive, le traitement (RIV) sera ce même PSMA couplé au Lutetium 177 (177 Lu). Dans le cas des cancers de la prostate résistants à la castration avec des métastases osseuses, la RIV propose un autre traitement plus spécifique des métastases osseuses en utilisant du dichlorure de radium 223 (223 Ra).
Dans le cas des tumeurs neuro-endocrines, les médecins nucléaires ciblent les récepteurs de la somatostatine avec un analogue de la molécule. L’imagerie TEP sera donc réalisée avec un analogue de la somatostatine marqué au 68 Ga, le 68Ga-Dotatoc ; une fois le diagnostic établi, le traitement sera mené avec un analogue flanqué de 177 Lu.
Les infrastructures nécessaires
Pour la réalisation de cette prise en charge, les services de médecines nucléaires doivent disposer de caméras (TEP/TEMP) mais aussi d’espaces de traitement. Selon le type de radionucléides, donc de médicaments radiopharmaceutiques utilisés, il peut s’agir de chambres ou box radioprotégées. Des systèmes de cuves pour le recueil des urines des patients peuvent aussi être nécessaires.
La radioactivité utilisée peut être produite au niveau d’établissements industriels de type réacteurs ou cyclotrons, mais peut aussi provenir de générateurs directement présents au sein des radiopharmacies.
La préparation des médicaments radiopharmaceutiques est réalisée en radiopharmacie : les médicaments diagnostiques peuvent être préparés en radiomarquant les molécules vectrices présentes au sein de trousses par des radionucléides issus de générateur, tandis que les médicaments thérapeutiques sont le plus souvent prêts à l’emploi.
Qu’il s’agisse de préparations réalisées de façon extemporanée ou de médicaments prêts à l’emploi, la radiopharmacie contrôle l’ensemble des médicaments dont elle assure la dispensation.
L’ensemble des locaux de la radiopharmacie est décrit au sein des Bonnes Pratiques de préparation 2023, de même que les exigences requises pour assurer la qualité de l’environnement de cette Zone à atmosphère contrôlée.
Tenir compte des niveaux de risques
Depuis le décret du 30 décembre 2021, l’activité de médecine nucléaire est classée en deux mentions, selon son niveau de risque :
mention A pour les actes diagnostiques ou thérapeutiques hors pathologies cancéreuses, réalisés par l'administration de médicament radiopharmaceutique prêt à l'emploi ou préparé conformément au résumé des caractéristiques du produit, selon un procédé aseptique en système clos. En établissement de santé disposant d’un service de médecine nucléaire et d’une PUI, cette dernière doit bénéficier d’une autorisation d’activité à risque dans le domaine de la radiopharmacie, avec la présence d’un radiopharmacien. Hors établissement de santé, le décret présente l’exercice et les missions du radiopharmacien.
mention B, pour les actes mentionnés en A mais aussi au moins un des actes suivants : ceux réalisés par l’administration de médicament radiopharmaceutique préparé selon un procédé aseptique en système ouvert, les actes diagnostiques dans le cadre d’explorations de marquages cellulaires des éléments figurés du sang par un ou des radionucléides, les actes thérapeutiques via l’administration de dispositif médical implantable actif, les actes thérapeutiques pour les pathologies cancéreuses via l’administration de médicaments radiopharmaceutiques. Cette mention B implique obligatoirement une PUI avec autorisation d’activité à risque dans le domaine de la radiopharmacie, avec la présence de radiopharmacien.
Une fois les médicaments préparés, l’administration au patient est réalisée. Là aussi, elle nécessite des installations particulières en médecine nucléaire selon les isotopes utilisés telles que chambre blindée, récupération des urines du patient, etc. en plus d’un personnel dédié formé à l’utilisation de médicaments radiopharmaceutiques. Le traitement se poursuit à intervalles réguliers sous forme de plusieurs cures.
Les perspectives
Outre l’utilisation de la théranostique dans le cas des cancers de la prostate et des tumeurs neuro-endocrines, des recherches sont menées pour trouver des marqueurs spécifiques dans d’autres cancers, par exemple dans le cancer du sein.
Les études se tournent aussi vers l’utilisation d’autres isotopes pour cibler encore plus spécifiquement les tumeurs : l’actinium 225, par exemple, émet des particules α plus énergétiques que le lutetium 177 (rayonnement β), de portée courte, ce qui le rend plus efficace pour détruire les cellules tumorales de manière localisée sans endommager les tissus sains environnants.
Il existe des enjeux pour une montée en puissance de la discipline : les besoins humains (personnel formé) et matériels (notamment en nombre de chambres disponibles) devront s’accroître pour faire face à l’afflux de patients. La théranostique nécessite en effet un travail d’équipe pluridisciplinaire qui mobilise différentes spécialités parmi lesquelles l’oncologue, le médecin nucléaire, le radiopharmacien, le physicien médical, mais aussi les personnels paramédicaux, tels que les manipulateurs radio, les préparateurs et les infirmières, qui doivent tous être rompus aux règles de la radioprotection et connaitre les exigences des MRP. À titre d’exemple, en 2024, seuls 40 % des besoins des patients auraient été couverts en radiopharmacie clinique. Dans les Hauts-de-France, sur 450 patients éligibles au traitement par an, le centre régional de lutte contre le cancer Oscar Lambret et le CHRU de Lille peuvent en prendre en charge 120 pour le moment.
Avec le Dr Anaïs Olivier, médecin et coordinatrice de médecine nucléaire au Centre de lutte contre le cancer Oscar Lambret (Lille) et le Dr Frédéric Debordeaux, radiopharmacien au CHU de Bordeaux, vice-président de la Société française de radiopharmacie (SoFRa).
-Theranostics in nuclear medicine practice, Yordanova et al. Onco Targets Ther. 2017
-Mallak et al. Theranostics in neuroendocrin tumors. Cancer Journal. May-june 2024.
Ichikawa et al. Neuroendocrine tumor theranostics. Cancer Sci. June 2022.
-Management of patients with advanced prostate cancer. Report from the 2024 advanced prostate cancer consensus conference (APCCC). European association of urology. Oct 2024.
-Langbein et al. Future of theranostics : an outlook on precision oncology in nuclear medicine. J Nucl Med 2019
-Jokar et al. Theranostic approach in breast cancer. A treasured tailor for future oncology. Clin Nucl led 2021.
-Koniar et al. Preclinical evaluation of 226 Ac as a theranostic agent : imaging, dosimetry and therapy. J Nucl Med 2024.
-Sartor et al. Lutetium-177–PSMA-617 for metastatic castration-resistant prostate cancer. NEJM. Sept 2021.
-Hofman et al. TheraP: a randomized phase 2 trial of 177Lu-PSMA-617 theranostic treatment vs cabazitaxel in progressive metastatic castration-resistant prostate cancer (Clinical Trial Protocol ANZUP 1603). BJI Int. 2019
- Sartor, O., de Bono, J., et al..et Al. Lutetium-177–PSMA-617 for Metastatic Castration-Resistant Prostate Cancer NEJM 2021
- Sartor, O et Al. LBA 13 Phase III trial of [177Lu]Lu-PSMA-617 in taxane-naive patients with metastatic castration-resistant prostate cancer (PSMAfore) Annals Of Oncology 2023.
Réglementation
- Décrets n° 2021-1930 du 30 décembre 2021 et n° 2022-114 du 1er février 2022 relatif aux conditions d'implantation et conditions techniques de fonctionnement de l'activité de médecine nucléaire.
- Modalités d’exercice du radiopharmacien selon les mentions A et B des activités de médecine nucléaire
À retenir
- La théranostique est une approche innovante de la médecine nucléaire combinant diagnostic et traitement. Un même vecteur moléculaire est marqué avec un isotope radioactif pour détecter les cellules cancéreuses via l'imagerie médicale, puis, si l'imagerie est positive, utilisé avec un isotope thérapeutique pour traiter la tumeur en ciblant précisément les cellules malades.
- Cette approche est déjà utilisée dans les cancers de la prostate et les tumeurs neuro-endocrines.
- La mise en place de la théranostique nécessite des équipements spécifiques et un personnel qualifié en radiopharmacie. La réglementation française distingue deux niveaux d’autorisation en médecine nucléaire (mention A et B), selon le niveau de risque et les procédures utilisées.
- Des recherches visent à étendre cette technique à d'autres cancers, comme le cancer du sein, et à améliorer les traitements avec de nouveaux isotopes. Cependant, la discipline fait face à des défis majeurs : le manque de personnel formé et d’infrastructures adaptées limite actuellement l’accès des patients à ces traitements.
Nos actualités
Le comité d'experts indépendants
Fait par des pharmaciens hospitaliers, pour des pharmaciens hospitaliers ! L'ensemble de nos contenus sont pensés et rédigés par un comités d'experts indépendants, cela pour mieux vous accompagner dans vos pratiques quotidiennes.